Міжнародна номенклатура алканів. Алкани: будова, властивості
Не зайве буде почати з визначення поняттяалканів. Це насичені або граничні вуглеводні, парафіни. Також можна сказати, що це вуглеці, в яких з'єднання атомів C здійснюється за допомогою простих зв'язків. Загальна формула має вигляд: CnH₂n + 2.
Відомо, що співвідношення кількості атомів H і Cв їх молекулах максимально, якщо порівнювати з іншими класами. З огляду на те що всі валентності зайняті або C, або H, хімічні властивості алканів виражені недостатньо яскраво, тому їх другою назвою виступає словосполучення граничні або насичені вуглеводні.
Також існує більш давнє найменування, яке найкраще відображає їх відносну хімінертность - парафіни, що в перекладі означає «позбавлені спорідненості».
Отже, тема нашої сьогоднішньої розмови: «Алкани: гомологічний ряд, номенклатура, будова, ізомерія». Також будуть представлені дані щодо їх фізичних властивостей.
Алкани: будова, номенклатура
У них атоми C перебувають в такому стані, якsp3-гібридизація. У зв'язку з цим молекулу алканів можна продемонструвати як набір тетраедричних структур C, які пов'язані не тільки між собою, а й з H.
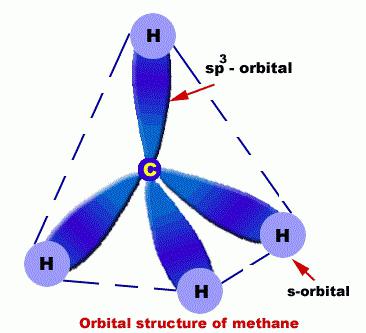
Між атомами C і H присутні міцні, вельмималополярние s-зв'язку. Атоми ж навколо простих зв'язків завжди обертаються, через що молекули алканів приймають різноманітні форми, причому довжина зв'язку, кут між ними - постійні величини. Форми, які трансформуються один в одного з-за обертання молекули, що відбувається навколо σ-зв'язків, прийнято називати її конформаціями.

У процесі відриву атома H від розглянутоїмолекули сформіровиваются 1-валентні частки, звані вуглеводневими радикалами. Вони з'являються в результаті з'єднань не тільки органічних речовин, але і неорганічних. Якщо відняти 2 атома водню від молекули граничного вуглеводню, то вийдуть 2-валентні радикали.
Таким чином, номенклатура алканів може бути:
- радіальної (старий варіант);
- замісної (міжнародна, систематична). Вона запропонована ІЮПАК.
Особливості радіальної номенклатури
У першому випадку номенклатура алканів характеризується наступним:
- Розгляд вуглеводнів в якості похідних метану, у якого заміщений 1 або кілька атомів H радикалами.
- Високий ступінь зручності в разі з не дуже складними сполуками.
Особливості замісної номенклатури
Замісна номенклатура алканів має такі особливості:
- Основа для назви - 1 вуглецевий ланцюг, інші ж молекулярні фрагменти розглядаються в якості заступників.
- При наявності декількох ідентичних радикалів перед їх найменуванням вказується число (строго прописом), а радикальні номера розділяються комами.
Хімія: номенклатура алканів
Для зручності інформація представлена у вигляді таблиці.
Назва речовини | Основа назви (корінь) | молекулярна формула | Назва вуглецевого заступника | Формула вуглецевого заступника |
метан | мет | CH₄ | метил | CH₃ |
Етан | Ет- | C₂H₆ | етил | C₂H₅ |
пропан | Проп- | C₃H₈ | пропив | C₃H₇ |
Бутан | Бут- | C₄H₁₀ | бутил | C₄H₉ |
пентан | Пент- | C₅H₁₂ | пентил | C₅H₁₁ |
гексан | Гекс- | C₆H₁₄ | гексил | C₆H₁₃ |
гептан | Гепт- | C₇H₁₆ | гептил | C₇H₁₅ |
октан | Окт- | C₈H₁₈ | октіл | C₈H₁₇ |
Нонан | нон | C₉H₂₀ | Ноніл | C₉H₁₉ |
декан | дек- | C₁₀H₂₂ | децил | C₁₀H₂₁ |
Вищевказана номенклатура алканів включає назви, які склалися історично (перші 4 члени ряду граничних вуглеводнів).
Найменування неразвернутих алканів з 5 і більшеатомами C утворені від грецьких числівників, які відображають дане число атомів C. Так, суфікс -а говорить про те, що речовина з ряду насичених з'єднань.

При складанні назв розгорнутих алканів вролі основного ланцюга вибирається та, яка містить максимальну кількість атомів C. Вона нумерується так, щоб заступники були з найменшим номером. У разі двох і більше ланцюгів однакової довжини головною стає та, яка містить найбільшу кількість заступників.
ізомерія алканів
Як вуглеводню-родоначальника їх рядувиступає метан CH₄. З кожним наступним представником метанового ряду спостерігається відміну від попереднього на метиленовую групу - CH₂. Ця закономірність простежується в усьому ряду алканів.
Німецький вчений Шиль висунув пропозицію назвати цей ряд гомологическом. У перекладі з грецького означає «подібний, подібний».
Таким чином, гомологічний ряд - набірродинних органічних сполук, що мають однотипну структуру з близькими хімсвойствамі. Гомологи - члени даного ряду. Гомологічна різниця - метиленовая група, на яку відрізняються 2 сусідніх гомолога.
Як уже згадувалося раніше, склад будь-якогонасиченого вуглеводню може бути виражений за допомогою загальної формули CnH₂n + 2. Так, наступним за метаном членом гомологічного ряду є етан - C₂H₆. Щоб вивести його структуру з метанової, необхідно замінити 1 атом H на CH₃ (малюнок нижче).
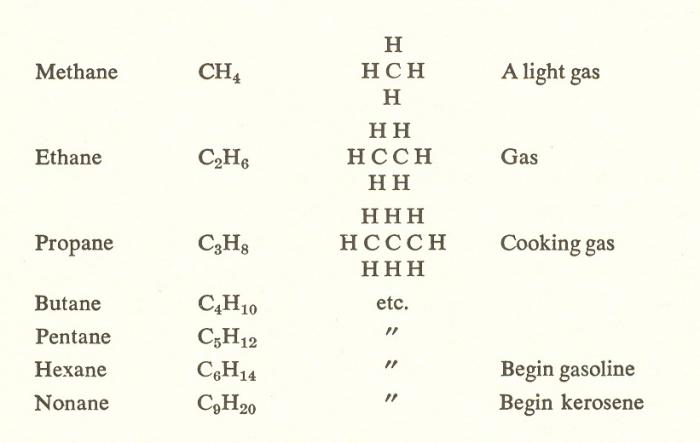
Структура кожного наступного гомолога може бути виведена з попереднього таким же чином. У підсумку з етану утворюється пропан - C₃H₈.
Що таке ізомери?
Це речовини, які мають ідентичнийякісний і кількісний молекулярний склад (ідентичну молекулярну формулу), проте різне хімічну будову, а також володіють різними хімсвойствамі.
Вишерассмотренние вуглеводні відрізняються затаким параметром, як температура кипіння: -0,5 ° - бутан, -10 ° - ізобутан. Даний вид ізомерії іменується як ізомерія вуглецевого скелета, вона відноситься до структурного типу.
Число структурних ізомерів зростає швидкимитемпами зі збільшенням кількості вуглецевих атомів. Таким чином, C₁₀H₂₂ буде відповідати 75 ізомерів (не включаючи просторові), а для C₁₅H₃₂ вже відомі 4347 ізомерів, для C₂₀H₄₂ - 366 319.
Отже, вже стало зрозуміло, що таке алкани, гомологічний ряд, ізомерія, номенклатура. Тепер варто перейти до правил складання назв по ІЮПАК.

Номенклатура ІЮПАК: правила утворення назв
По-перше, необхідно відшукати в вуглеводневоїструктурі вуглецевий ланцюг, яка найбільш довга і містить максимальну кількість заступників. Потім потрібно пронумерувати атоми C ланцюга, починаючи з кінця, до якого ближче всього розташований заступник.
По-друге, основа - назва неразветвленного насиченого вуглеводню, якому за кількістю атомів C відповідає найголовніша ланцюг.
По-третє, перед основою необхідно вказати номери локантов, біля яких розташовані заступники. За ними записуються через дефіс назви заступників.
По-четверте, в разі наявності ідентичнихзаступників при різних атомах C локанти об'єднуються, при цьому перед назвою з'являється примножує приставка: ді - для двох ідентичних заступників, три - для трьох, тетра - чотирьох, пента - для п'яти і т. д. Цифри повинні бути відокремлені один від одного комами, а від слів - дефісом.
Якщо один і той же атом C міститься відразу два заступника, локант теж записується двічі.
Згідно з цими правилами і формується міжнародна номенклатура алканів.
проекції Ньюмена
Цей американський вчений запропонував для графічної демонстрації конформаций спеціальні проекційні формули - проекції Ньюмена. Вони відповідають формам А і Б і представлені на малюнку нижче.

У першому випадку це А-заслоненная конформація, ау другому - Б-загальмована. У позиції А атоми H розташовуються на мінімальній відстані один від одного. Даною формі відповідає найбільше значення енергії, з огляду на те що відштовхування між ними найбільше. Це енергетично невигідне стан, внаслідок чого молекула прагне покинути його і перейти до більш стійкого положення Б. Тут атоми H максимально віддалені один від одного. Так, енергетична різниця цих положень - 12 кДж / моль, завдяки чому вільне обертання навколо осі в молекулі етану, яка з'єднує метильние групи, виходить нерівномірним. Після потрапляння в енергетично вигідне становище молекула там затримується, іншими словами, «гальмується». Саме тому воно і називається загальмованим. Результат - 10 тис. Молекул етану перебувають в загальмованою формі конформації за умови кімнатної температури. Тільки одна має іншу форму - заслоненного.
Отримання насичених вуглеводнів
Зі статті вже стало відомо, що це алкани(Будова, номенклатура їх детально описані раніше). Буде не зайве розглянути способи їх отримання. Вони виділяються з таких природних джерел, як нафта, природний, попутний газ, кам'яне вугілля. Застосовуються також і синтетичні методи. Наприклад, H₂ 2H₂:
- Процес гідрування ненасичених вуглеводнів: CnH₂n (алкени) → CnH₂n + 2 (алкани) ← CnH₂n-2 (Алкіни).
- З суміші монооксиду C і H - синтез-газу: nCO + (2n + 1) H₂ → CnH₂n + 2 + nH₂O.
- З карбонових кислот (їх солей): електроліз на аноді, на катоді:
- електроліз Кольбе: 2RCOONa + 2H₂O → R-R + 2CO₂ + H₂ + 2NaOH;
- реакція Дюма (сплав з лугом): CH₃COONa + NaOH (t) → CH₄ + Na₂CO₃.
- Крекінг нафти: CnH₂n + 2 (450-700 °) → CmH₂m + 2 + Cn-mH₂ (n-m).
- Газифікація палива (твердого): C + 2H₂ → CH₄.
- Синтез складних алканів (галогенопроізводних), які мають меншу кількість атомів C: 2CH₃Cl (хлорметан) + 2Na → CH₃- CH₃ (етан) + 2NaCl.
- Розкладання водою метанідов (карбідів металів): Al₄C₃ + 12H₂O → 4Al (OH₃) ↓ + 3CH₄ ↑.
Фізичні властивості насичених вуглеводнів
Для зручності дані згруповані в таблицю.
Формула | Алкана | Температура плавлення в ° С | Температура кипіння в ° С | Щільність, г / мл |
CH₄ | метан | -183 | -162 | 0,415 при t = -165 ° С |
C₂H₆ | Етан | -183 | -88 | 0,561 при t = -100 ° C |
C₃H₈ | пропан | -188 | -42 | 0,583 при t = -45 ° C |
н-C₄H₁₀ | н-Бутан | -139 | -0,5 | 0,579 при t = 0 ° C |
2-метілпропан | - 160 | - 12 | 0,557 при t = -25 ° C | |
2,2-диметил-пропан | - 16 | 9,5 | 0,613 | |
н-C₅H₁₂ | н-Пентан | -130 | 36 | 0,626 |
2-метилбутан | - 160 | 28 | 0,620 | |
н-C₆H₁₄ | н-Гексан | - 95 | 69 | 0,660 |
2-метилпентан | - 153 | 62 | 0,683 | |
н-C₇H₁₆ | н-Гептан | - 91 | 98 | 0,683 |
н-C₈H₁₈ | н-Октан | - 57 | 126 | 0,702 |
2,2,3,3-Тетра-метилбутан | - 100 | 106 | 0,656 | |
2,2,4-триметил-пентан | - 107 | 99 | 0,692 | |
н-C₉H₂₀ | н-Нонан | - 53 | 151 | 0,718 |
н-C₁₀H₂₂ | н-Декан | - 30 | 174 | 0,730 |
н-C₁₁H₂₄ | н-ундекан | - 26 | 196 | 0,740 |
н-C₁₂H₂₆ | н-додекан | - 10 | 216 | 0,748 |
н-C₁₃H₂₈ | н-тридекан | - 5 | 235 | 0,756 |
н-C₁₄H₃₀ | н-тетрадекан | 6 | 254 | 0,762 |
н-C₁₅H₃₂ | н-Пентадекан | 10 | 271 | 0,768 |
н-C₁₆H₃₄ | н-гексадекан | 18 | 287 | 0,776 |
н-C₂₀H₄₂ | н-ейкозан | 37 | 343 | 0,788 |
н-C₃₀H₆₂ | н-тріаконтан | 66 | 235 при 1 мм рт. ст | 0,779 |
н-C₄₀H₈₂ | н-Тетраконтан | 81 | 260 при 3 мм рт. ст. | |
н-C₅₀H₁₀₂ | н-Пентаконтан | 92 | 420 при 15 мм рт. ст. | |
н-C₆₀H₁₂₂ | н-Гексаконтан | 99 | ||
н-C₇₀H₁₄₂ | н-Гептаконтан | 105 | ||
н-C₁₀₀H₂₀₂ | н-Гектан | 115 |
висновок
У статті було розглянуто таке поняття, якалкани (будова, номенклатура, ізомерія, гомологічний ряд і ін.). Трохи розповів про особливості радіальної і замісної номенклатур. Описано способи отримання алканів.
Крім того, в статті детально перераховано всю номенклатура алканів (тест може допомогти засвоїти отриману інформацію).