Реакція сполуки. Приклади реакції з'єднання
Багато процесів, без яких неможливоуявити наше життя (такі як дихання, травлення, фотосинтез і подібні до них), пов'язані з різними хімічними реакціями органічних сполук (і неорганічних). Давайте розглянемо основні їх види і більш детально зупинимося на процесі під назвою з'єднання (приєднання).
Що називається хімічною реакцією
Перш за все варто назвати загальну визначення цьогоявищу. Під даним словосполученням маються на увазі різні реакції речовин різної складності, в результаті яких утворюються відмінні від вихідних продукти. Беруть участь в цьому процесі речовини називаються "реагенти".
На листі хімічна реакція органічнихз'єднань (і неорганічних) записується за допомогою спеціалізованих рівнянь. Зовні вони трохи нагадують математичні приклади по складанню. Однак замість знака рівності ( "=") використовуються стрілки ( "→" або "⇆"). Крім цього в правій частині рівняння іноді може бути більше речовин, ніж в лівій. Все, що знаходиться до стрілки, - це речовини до початку реакції (ліва частина формули). Все, що після неї (права частина), - з'єднання, що утворилися в результаті події хімічного процесу.
Як приклад хімічного рівняння можна розглянути реакцію розкладання води на водень і кисень під дією електричного струму: 2Н2Про → 2Н2↑ + Про2↑. Вода - це вихідний реагент, а кисень з воднем - продукти.
В якості ще одного, але вже більш складногоприкладу хімічної реакції сполук можна розглянути явище, знайоме кожній господині, хоч раз випікати солодощі. Йдеться про гасінні харчової соди за допомогою столового оцту. Те, що відбувається дія ілюструється за допомогою такого рівняння: NaHCO3 +2 СН3СООН → 2CH3COONa + СО2↑ + Н2О. З нього ясно, що в процесі взаємодії бікарбонату натрію і оцту утворюється натрієва сіль оцтової кислоти, вода і вуглекислий газ.
За свій природі хімічні процеси займає проміжне місце між фізичними і ядерними.
На відміну від перших, які беруть участь в хімічнихреакціях з'єднання здатні змінювати свій склад. Тобто з атомів однієї речовини можна утворити кілька інших, як у вищезгаданому рівнянні розкладання води.
На відміну від ядерних реакцій хімічні торкається ядра атомів взаємодіючих речовин.
Які бувають види хімічних процесів
Розподіл реакцій з'єднань за видами відбувається за різними критеріями:

- Оборотність / незворотність.
- Наявність / відсутність каталізують речовин і процесів.
- За поглинанню / виділенню тепла (ендотермічна / екзотермічна реакції).
- За кількістю фаз: гомогенні / гетерогенні і дві гібридні їх різновиди.
- За зміною ступенів окислення взаємодіючих речовин.
Види хімічних процесів в неорганічної хімії за способом взаємодії
Цей критерій є особливим. З його допомогою виділяють чотири різновиди реакцій: сполучення, заміщення, розкладання (розщеплення) і обмін.

Назва кожної з них відповідає процесу,який вона описує. Тобто в з'єднанні речовини об'єднуються, в заміщенні - змінюються на інші групи, в розкладанні з одного реагенту утворюється кілька, а в обміні учасники реакції змінюються між собою атомами.
Види процесів за способом взаємодії в органічній хімії
Незважаючи на велику складність, реакції органічних сполук відбуваються за тим же принципом, що і неорганічні. Однак вони мають дещо відмінні назви.
Так, реакції з'єднання і розкладання іменуються«Приєднання», а також «відщеплення» (елімірованіе) і безпосередньо органічне розкладання (в цьому розділі хімії присутні два типи процесів розщеплення).
Інші реакції органічних сполук - цезаміщення (назва не змінюється), перегрупування (обмін) і окислювально-відновні процеси. Незважаючи на схожість механізмів їх протікання, в органіці вони більш багатогранні.
Хімічна реакція сполуки
Розглянувши різні види процесів, в які вступають речовини в органічної та неорганічної хімії, варто зупинитися більш докладно саме на з'єднанні.
Дана реакція відрізняється від усіх інших тим, що, незалежно від кількості реагентів на її початку, в фіналі вони все з'єднуються в одне.
Як приклад можна згадати процес гасіння вапна: СаО + Н2Про → Са (ОН)2. В даному випадку відбувається реакція сполукиоксиду кальцію (негашеного вапна) з оксидом гідрогену (водою). В результаті утворюється гідроксид кальцію (гашене вапно) і виділяється тепла пара. До речі, це означає, що даний процес дійсно екзотермічний.
Рівняння реакції з'єднання
Схематично даний процес можназобразити таким чином: А + БВ → АБВ. У цій формулі АБВ - це новостворене складна речовина, А - простий реагент, а БВ - варіант складної сполуки.

Варто зазначити, що ця формула характерна і для процесу приєднання та з'єднання.
Приклади реакції розглянутої - це взаємодія оксиду натрію і вуглекислого газу (NaO2 + СО2↑ (t 450-550 ° С) → Na2CO3), А також оксиду сірки з киснем (2SO2 + O2↑ → 2SO3).
Також між собою здатні реагувати кілька складних з'єднань: АБ + ВГ → АБВГ. Наприклад, все той же оксид натрію і оксид гідрогену: NaO2 + Н2Про → 2NaOH.
Умови протікання реакції в неорганічних сполуках
Як було показано в попередньому рівнянні, в аналізованих взаємодія здатні вступати речовини різного ступеня складності.

При цьому для простих реагентів неорганічного походження можливі окислювально-відновні реакції з'єднання (А + В → АБ).
Як приклад можна розглянути процес отримання тривалентного хлориду заліза. Для цього проводиться реакція сполуки між хлором і Ферум (залізом): 3Cl2↑ + 2Fe → 2FeCl3.
У разі якщо мова йде про взаємодію складних неорганічних речовин (АБ + ВГ → АБВГ), процеси в них здатні відбуватися, як впливаючи, так і не впливаючи на їх валентність.
Як ілюстрацію до цього варто розглянути приклад освіти гідрокарбонату кальцію з вуглекислого газу, оксиду гідрогену (води) і білого харчового барвника Е170 (карбонату кальцію): СО2↑ + Н2Про + СаСО3 → Са (СО3)2. В даному випадку має місце класична реакція сполуки. При її здійсненні валентність реагентів не змінюється.
Трохи більш досконале (ніж перше) хімічне рівняння 2FeCl2 + Cl2↑ → 2FeCl3 є прикладом окислювально-відновного процесу при взаємодії простого і складного неорганічних реагентів: газу (хлору) і солі (хлориду заліза).
Види реакцій приєднання в органічній хімії
Як вже було зазначено в четвертому пункті, вречовинах органічного походження розглянута реакція іменується «приєднанням». Як правило, в ній беруть участь складні речовини з подвійною (або потрійний) зв'язком.
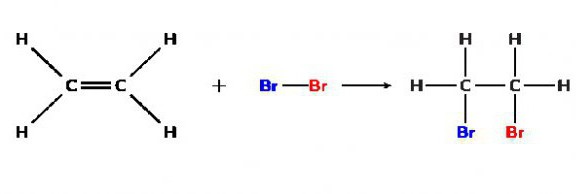
Наприклад, реакція між дібромом і етиленом, яка призводить до утворення 1,2-диброметану: (С2Н4) СН2= СН2 + Br2 → (C₂H₄Br₂) BrCH2 - CH2Br. До речі, знаки схожі на одно і мінус ( "=" і "-"), в даному рівнянні показують зв'язки між атомами складного речовини. Це особливість записи формул органічних речовин.
Залежно від того, які з з'єднань виступають в ролі реагентів, виділяються кілька різновидів даного процесу приєднання:
- Гідрування (додаються молекули гідрогену Н по кратному зв'язку).
- Гідрогалогенірованіе (приєднується галогеноводородами).
- Галогенування (додавання галогенів Br2, Cl2↑ і подібних).
- Полімеризація (утворення з декількох низькомолекулярних сполук речовин з високою молекулярною масою).
Приклади реакції приєднання (з'єднання)
Після перерахування різновидів даного процесу варто дізнатися на практиці деякі приклади реакції з'єднання.
В якості ілюстрації гідрування можна звернути увагу на рівняння взаємодії пропена з воднем, в результаті якого виникне пропан: (С3Н6↑) СН3СН = СН2↑ + Н2↑ → (С3Н8↑) СН3СН2СН3↑.
У органічної хімії реакція сполуки (приєднання) може відбуватися між соляною кислотою (неорганічне речовина) і етиленом з формуванням хлоретану: (С2Н4↑) СН2= СН2↑ + HCl → CH3- CH2-Cl (C2H5Cl). Представлене рівняння є прикладом гідрогалогенірованіе.

Що стосується галогенування, то його можна ілюструвати реакцією між дихлоро і етиленом, що веде до утворення 1,2-дихлоретану: (С2Н4↑) СН2= СН2 + Cl2↑ → (C₂H₄Cl₂) ClCH2-CH2Cl.
Безліч корисних речовин утворюєтьсязавдяки органічної хімії. Реакція сполуки (приєднання) молекул етилену з радикальним ініціатором полімеризації під впливом ультрафіолету - тому підтвердження: n СН2 = СН2 (R і УФ-світло) → (СН2СН2-) n. Утворене таким способом речовина добре відомо кожній людині під ім'ям поліетилену.

З цього матеріалу виготовляються різні видиупаковок, пакети, посуд, труби, утеплюють речовини і багато іншого. Особливістю даної речовини є і можливість його вторинної переробки. Своєю популярністю поліетилен зобов'язаний тому, що не розкладається, через що екологи негативно ставляться до нього. Однак в останні роки був знайдений спосіб безпечної утилізації виробів з поліетилену. Для цього матеріал обробляється азотною кислотою (HNO3). Після чого окремі види бактерій здатні розкладати цю речовину на безпечні складові.
Реакція сполуки (приєднання) грає важливуроль у природі та житті людини. Крім цього, вона часто використовується вченими в лабораторіях, щоб синтезувати нові речовини для різних важливих досліджень.