Регуляція активності ферментів і їх способи
Будучи одиницею живої матерії, що функціонуєяк комплекс відкритих біосистем, клітина постійно обмінюється з зовнішнім середовищем речовинами і енергією. Для підтримки гомеостазу в ній існує група особливих речовин білкової природи - ензимів. Будова, функції, а також регуляція активності ферментів вивчаються спеціальної галуззю біохімії, званої ензимологія. У даній статті на конкретних прикладах ми розглянемо різні механізми і способи регуляції активності ферментів, властиві вищим ссавцям і людині.
Умови, необхідні для оптимальної активності ензимів
Біологічно активні речовини, вибіркововпливають як на реакції асиміляції, так і на розщеплення, проявляють свої каталітичні властивості в клітинах при певних умовах. Наприклад, важливо з'ясувати, в якій ділянці клітини протікає хімічний процес, в якому беруть участь ензими. Завдяки компартментаціі (поділу цитоплазми на ділянки) антагоністичні реакції відбуваються в різних її частинах і органелах.

Так, синтез білків здійснюється в рибосомах, аїх розщеплення - в гіалоплазме. Клітинна регуляція активності ферментів, які каталізують протилежні біохімічні реакції, забезпечує не тільки оптимальну швидкість протікання обміну речовин, але і перешкоджає формуванню енергетично непотрібних метаболічних шляхів.
Мультиферментний комплекс
Структурно-функціональна організація ензимівутворює ферментативний апарат клітини. Більшість хімічних реакцій, що протікають в ній, взаємопов'язані. Якщо в багатостадійному хімічному процесі продукт першої реакції є реагентом для подальшої, в цьому випадку просторове розташування ензимів в клітці виражено особливо сильно.
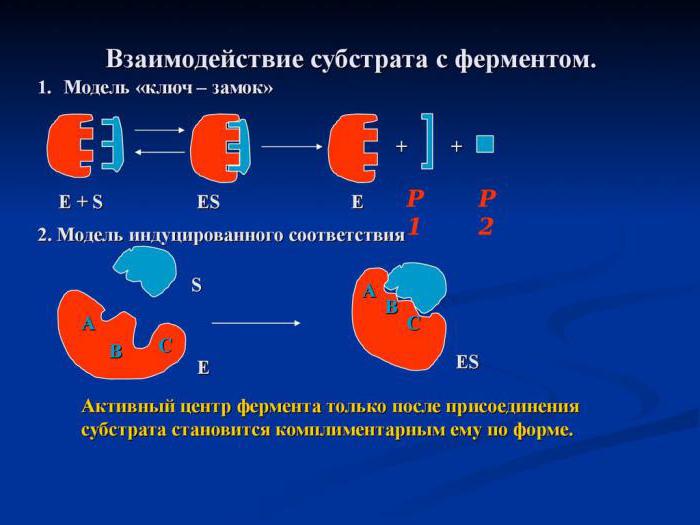
Потрібно пам'ятати, що ферменти є по своїйприроді простими або складними білками. І їх чутливість до клітинного субстрату пояснюється насамперед зміною власної просторової конфігурації третинної або четвертинної структури пептиду. Ензими реагують і на зміни не тільки всередині клітинних параметрів, таких як хімічний склад гіалоплазми, концентрацію реагентів і продуктів реакції, температуру, але і на зміни, що відбуваються в сусідніх клітках або в міжклітинної рідини.
Чому клітина розділена на компартменти
Розумність і логічність пристрої живої природипросто разюча. Це в повній мірі відноситься і до життєвих проявів, характерним для клітини. Для вченого-хіміка абсолютно зрозуміло, що різноспрямовані ферментативні хімічні реакції, наприклад синтез глюкози і гліколіз, не можуть протікати в одній і тій же пробірці. Як же тоді відбуваються протилежні реакції в гіалоплазме однієї клітини, що є субстратом для їх проведення? Виявляється, клітинне вміст - цитозоль, - в якому здійснюються антагоністичні хімічні процеси, просторово розділене і утворює ізольовані локуси - компартменти. Завдяки їм метаболічні реакції вищих ссавців і людини регулюються особливо точно, а продукти обміну перетворюються у форми, вільно проникають через перегородки клітинних ділянок. Далі вони відновлюють свою первісну структуру. Крім цитозоля, ферменти містяться в органелах: рибосомах, мітохондріях, ядрі, лизосомах.
Роль ензимів в енергетичному обміні
Розглянемо окислювальне декарбоксилюванняпірувату. Регуляція каталітичної активності ферментів в ньому добре вивчена ензимологія. Даний біохімічний процес протікає в мітохондріях - двумембранних органелах еукаріотичних клітин - і є проміжним процесом між безкисневим розщепленням глюкози і циклом Кребса. Піруватдегідрогеназний комплекс - PDH - містить три ферменту. У вищих ссавців і людини зниження його відбувається при підвищенні концентрації Ацетил-КоА і NATH, тобто в разі появи альтернативних можливостей освіти молекул Ацетил-КоА. Якщо ж клітина потребує додаткової порції енергії і вимагає нових молекул акцептора для посилення реакцій циклу трикарбонових кислот, то ферменти активуються.

Що таке аллостеріческого інгібування
Регуляція активності ферментів можездійснюватися спеціальними речовинами - каталитическими інгібіторами. Вони можуть ковалентно зв'язуватися з певними локусами ензиму, минаючи його активний центр. Це призводить до деформації просторової структури каталізатора і автоматично тягне за собою зниження його ферментативних властивостей. Іншими словами, відбувається аллостерічеськая регуляція активності ферментів. Додамо також, що така форма каталітичного впливу властива олігомерного ензимам, тобто тим, чиї молекули складаються з двох і більше полімерних білкових субодиниць. Розглянутий в попередньому заголовку PDH-комплекс як раз і містить три олігомерних ферменту: піруват дегідрогеназу, дегідроліпоіл дегідрогеназу і гідроліпоіл трансацетілазу.
регуляторні ферменти
Дослідження в ензимології встановили той факт,що швидкість хімічних реакцій залежить як від концентрації, так і від активності каталізатора. Найчастіше метаболічні шляхи містять головні ферменти, що регулюють швидкість реакцій на всіх його ділянках.

Вони називаються регуляторними та зазвичайвпливають на початкові реакції комплексу, а також можуть брати участь в найбільш повільно протікають хімічні процеси в необоротних реакціях, або ж приєднаються до реагентів в точках розгалуження метаболічного шляху.
Як здійснюється пептидних взаємодія
Одним із способів, за допомогою якого відбуваютьсярегуляція активності ферментів в клітці, є білок-білкове взаємодія. Про що мова? Здійснюється приєднання регуляторних білків до молекули ензимів, внаслідок чого відбувається їх активація. Наприклад, фермент аденилатциклаза знаходиться на внутрішній поверхні клітинної мембрани і може взаємодіяти з такими структурами, як рецептор гормону, а також з пептидом, розташованим між ним і ферментом. Так як в результаті з'єднання гормону і рецептора проміжний білок змінює свою просторову конфірмацію, цей спосіб посилення каталітичних властивостей аденілатциклази в біохімії носить назву «активації внаслідок приєднання білків-регуляторів».
Протомери і їх роль в біохімії
Ця група речовин, інакше звана протєїнкиназамі, прискорять перенесення аніона PO43- на гидроксогрупп амінокислот, що входять впептидную макромолекулу. Регуляція активності ферментів протомеров буде розглянута нами на прикладі протеїнкінази А. Її молекула - тетрамер, складається з двох каталітичних і двох регуляторних пептидних субодиниць і не функціонує як каталізатор до тих пір, поки до регуляторних ділянках протомеров НЕ прикріпити чотири молекули цАМФ. Це викликає трансформацію просторової структури білків-регуляторів, що призводить до вивільнення двох активованих каталітичних білкових частинок, тобто відбувається дисоціація протомеров. Якщо ж від регуляторних субодиниць відокремлюються молекули цАМФ, то неактивний комплекс протеїнкінази знову відновлюється до тетрамера, так як відбувається асоціація каталітичних і регуляторних пептидних частинок. Таким чином, розглянуті вище шляху регуляції активності ферментів забезпечують їх оборотний характер.
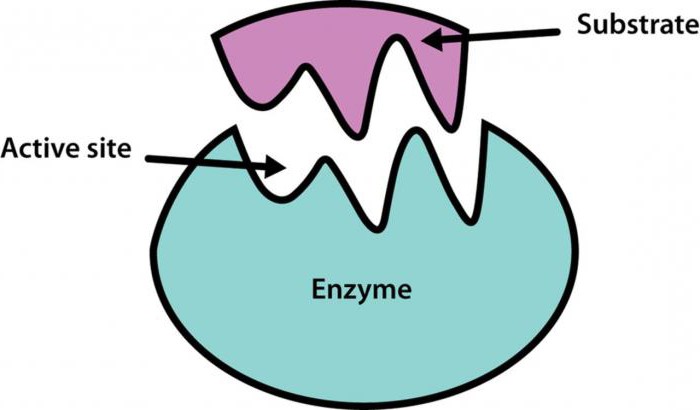
Хімічна регуляція активності ферментів
Біохімія вивчила і такі механізми регуляціїактивності ферментів, як фосфорилювання, дефосфорілірованіе. Механізм регуляції активності ферментів в даному випадку має такий вигляд: амінокислотні залишки ензиму, що містять групи ОН-, Змінюють свою хімічну модифікацію внаслідоквпливу на них фосфопротеінфосфатаз. В цьому випадку корекції піддається активний центр, причому для одних ензимів це є причиною, що активує їх, а для інших - інгібуючої. У свою чергу каталітичні властивості самих фосфопротеінфосфатаз регулюються гормоном. Наприклад, тваринний крохмаль - глікоген - і жир в проміжках між прийомами їжі розщеплюються в шлунково-кишковому тракті, точніше, в дванадцятипалій кишці під впливом глюкагону - панкреатичного ферменту.
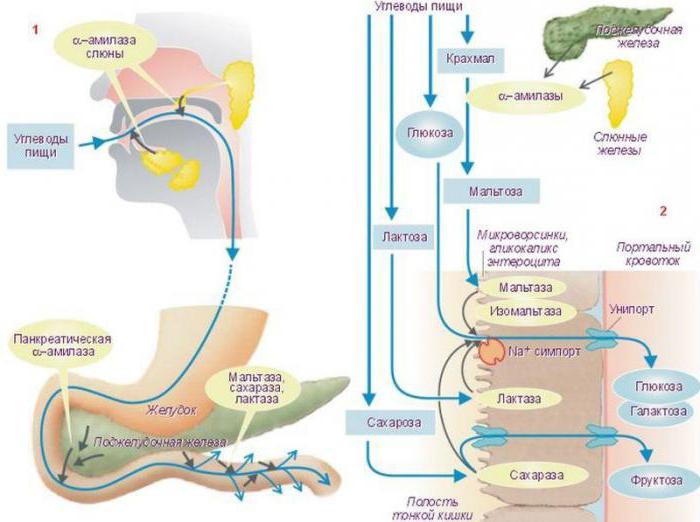
Цей процес посилюється завдякифосфорилированию трофічних ензимів ШКТ. В період активного травлення, коли їжа надходить зі шлунка в дванадцятипалу кишку, синтез глюкагону посилюється. Інсулін - ще один фермент підшлункової залози, що виробляється альфа-клітинами острівців Лангерганса, - взаємодіє з рецептором, включаючи механізм фосфорилювання тих же травних ензимів.
частковий протеоліз
Як бачимо, рівні регуляції активності ферментівв клітці різноманітні. Для ензимів, які перебувають поза цитозоля або органоїдів (в плазмі крові або в шлунково-кишковому тракті), способом їх активації служить процес гідролізу пептидних зв'язків CO-NH. Він необхідний, так як такі ферменти синтезуються в неактивній формі. Від молекули ензиму отщепляется пептидная частина, а в що залишилася структурі модифікації піддається активний центр. Це призводить до того, що фермент «входить в робочий стан», тобто стає здатним впливати на перебіг хімічного процесу. Наприклад, неактивний фермент підшлункової залози трипсиноген не розщеплюється білки їжі, що надходять в дванадцятипалу кишку. У ній під дією ентеропептідази відбувається протеоліз. Після чого ензим активується і називається тепер трипсином. Частковий протеоліз - процес оборотний. Він відбувається в таких випадках, як активація ензимів, що розщеплюють поліпептиди, в процесах згортання крові.
Роль концентрації вихідних речовин в метаболізмі клітини
Регуляція активності ферменту доступністюсубстрату частково розглядалася нами в підзаголовку «Мультиферментний комплекс». Швидкість протікання каталітичних реакцій, що проходять в кілька стадій, сильно залежить від того, скільки молекул вихідної речовини знаходиться в гіалоплазме або органелах клітини. Це пов'язано з тим, що швидкість метаболічного шляху прямо пропорційна концентрації вихідної речовини. Чим більше молекул реагенту знаходиться в цитоплазмі, тим вище швидкість всіх наступних хімічних реакцій.
аллостерічеськая регуляція
Ферментам, активність яких контролює нетільки концентрацією вихідних речовин-реагентів, але ще і речовинами-ефекторами, властива так звана аллостерічеськая регуляція. Найчастіше такі ензими представлені проміжними продуктами обміну речовин в клітині. Завдяки ефекторів і здійснюється регуляція активності ферментів. Біохімія довела, що такі сполуки, названі аллостеріческого ензимами, дуже важливі для метаболізму клітини, так як мають надзвичайно високу чутливість до змін її гомеостазу. Якщо ензим пригнічує хімічну реакцію, тобто знижує її швидкість - його називають негативним ефектором (інгібітором). В протилежному випадку, коли спостерігається збільшення швидкості реакції, мова йде про активаторі - позитивному ефектори. У більшості випадків вихідні речовини, тобто реагенти, які вступають в хімічні взаємодії, грають роль активаторів. Кінцеві ж, продукти, що утворилися в результаті багатостадійний реакцій, поводяться як інгібітори. Такий вид регуляції, побудованої на взаємозв'язку концентрації реагентів і продуктів, називається гетеротрофним.