Електрофільне приєднання в органічній хімії
Для реакцій приєднання характерно освітуоднієї хімічної сполуки з двох або більшої кількості вихідних продуктів. Розглядати механізм електрофільного приєднання зручно на прикладі алкенів - ненасичених ациклічних вуглеводнів з одним подвійним зв'язком. Крім них, в такі перетворення вступають інші вуглеводні з кратними зв'язками, в тому числі циклічні.
Етапи взаємодії вихідних молекул
Електрофільне приєднання проходить в кількаетапів. Електрофіл, що має позитивний заряд, виступає в ролі акцептора електронів, а подвійний зв'язок молекули алкена - в ролі донора електронів. Обидва з'єднання спочатку утворюють нестабільний п-комплекс. Потім починається перетворення π-комплексу в ϭ-комплекс. Освіта карбокатіон на цьому етапі і його стійкість визначають швидкість взаємодії в цілому. Після цього карбокатіон швидко взаємодіє з частково негативно зарядженим нуклеофілом, і утворюється кінцевий продукт перетворення.
Вплив замісників на швидкість реакції
Делокалізація заряду (ϭ +) в карбокатіон залежитьвід будови вихідної молекули. Позитивний індуктивний ефект, який проявляє алкильная група, призводить до зниження заряду сусіднього вуглецевого атома. В результаті цього в молекулі з електронодонорності заступником підвищується відносна стабільність катіона, електронна щільність π-зв'язку і реакційна здатність молекули в цілому. Вплив електроноакцепторов на реакційну здатність буде протилежним.
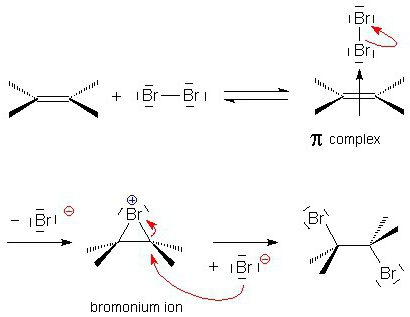
Механізм приєднання галогенів
Розберемо більш детально механізм реакції електрофільного приєднання на прикладі взаємодії алкена і галогену.
- Молекула галогену зближується з подвійним зв'язкомміж вуглецевими атомами і поляризується. За рахунок частково позитивного заряду на одному з кінців молекули галоген відтягує на себе електрони π-зв'язку. Так відбувається формування нестійкого π-комплексу.
- На наступному етапі електрофільне частка з'єднується з двома атомами вуглецю, утворюючи цикл. З'являється циклічний «Онієву» іон.
- Частина, що залишилася зарядженачастка галогену(Позитивно заряджений нуклеофил) взаємодіє з Онієву іоном і приєднується з протилежного боку від попередньої частки галогену. З'являється кінцевий продукт - транс-1,2-дігалогеналкан. Аналогічно відбувається приєднання галогену до циклоалкеніл.
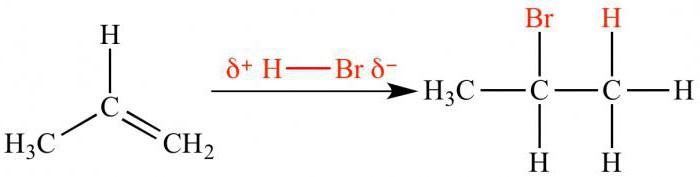
Механізм приєднання галогеноводородних кислот

Реакції електрофільного приєднаннягалогеноводородов і сірчаної кислоти протікають інакше. У кислому середовищі відбувається дисоціація реагенту на катіон і аніон. Позитивно заряджений іон (електрофіл) атакує π-зв'язок, з'єднується з одним з вуглецевих атомів. Утворюється карбокатіон, в якій сусідній вуглецевий атом заряджається позитивно. Далі карбокатіон реагує з аніоном, формуючи кінцевий продукт реакції.
Напрямок реакції між асиметричними реагентами і правило Марковникова

Електрофільне приєднання між двоманесиметричними молекулами протікає регіоселективно. Це означає, що з двох можливих ізомерів переважно утворюється тільки один. Регіоселективність описує правило Марковникова, згідно з яким водень приєднується до вуглецевого атома, з'єднаному з великою кількістю інших атомів водню (до більш гідрогенізовані).
Щоб зрозуміти суть цього правила, потрібно згадатипро те, що швидкість реакції залежить від стійкості проміжного карбокатіон. Про вплив електронодонорні і акцепторних заступників говорилося вище. Так, електрофільне приєднання бромоводородной кислоти до пропеніл призведе до утворення 2-бромпропана. Проміжний катіон з позитивним зарядом на центральному вуглецевому атомі стійкіше карбокатіон з позитивним зарядом на крайньому атомі. В результаті атом брому взаємодіє з другим атомом вуглецю.
Вплив електроноакцепторні заступника на хід взаємодії
Якщо вихідна молекула міститьелектроноакцепторний заступник, що володіє негативним індуктивним і / або мезомерним ефектом, електрофільне приєднання йде проти вищеописаного правила. Приклади таких заступників: CF3, COOH, CN. У цьому випадку велика віддаленість позитивного заряду від електроноакцепторні групи робить первинний карбокатіон більш стабільним. В результаті водень з'єднується з менш гідрогенізовані вуглецевим атомом.
Універсальний варіант правила буде виглядати так: при взаємодії несиметричного алкена і несиметричного реагенту реакція протікає по шляху утворення найбільш стійкого карбокатіон.







